Klinische Bewertung MEDDEV 2.7.1 Medizinprodukte MDR
Klinische Daten vs klinische Bewertung vs Leistungsdaten
Für jedes Medizinprodukt muss, basierend auf klinischen Daten, die Sicherheit und Leistung, einschließlich des klinischen Nutzens, überprüft werden. Klinische Daten können dabei über eine klinische Prüfung des eigenen Produkts generiert werden oder basierend auf äquivalenten Produkten (Gleichartigkeit in klinischen, technischen und biologischen Charakteristika gemäß MDR, Anhang XIV, Abs. 3) aufgezeigt werden. Die europäische Kommission hat dazu einen MEDDEV Leitfaden (MEDDEV 2.7 1) veröffentlicht, der zur Zeit noch das wichtigste Dokument in diesem Bereich unter der MDR (europäische Medizinprodukteverordnung) ist.
Entsprechend kann eine klinische Bewertung aus der kritischen Bewertung der einschlägigen derzeit verfügbaren wissenschaftlichen Fachliteratur über Sicherheit, Leistung, Auslegungsmerkmale und Zweckbestimmung des Produkts und der kritischen Bewertung aller verfügbaren klinischen Prüfungen bestehen. Für implantierbare Produkte und Produkte der Klasse III kann unter bestimmten Voraussetzungen eine klinische Prüfung zwingend notwendig sein.
Die MDR fordert in Artikel 10 unter den allgemeinen Pflichten der Hersteller, dass diese eine klinische Bewertung nach Maßgabe der in Artikel 61 und in Anhang XIV festgelegten Anforderungen durchführen, welche auch die klinische Nachbeobachtung (Marktbeobachtung) nach dem Inverkehrbringen (PMCF) umfasst.
Einzelheiten zur Durchführung sind insbesondere der MDR, Anhang XIV, den MDCG (Medical Device Coordination Group) Papieren 2020-5 und 2020-6 sowie dem Leitfaden MEDDEV 2.7 1 rev. 4 zu entnehmen. Diese Dokumente beschreiben, wie eine klinische Bewertung aufzubauen ist und welche Elemente notwendig sind, um die Konformität mit den Grundlegenden Sicherheits- und Leistungsanforderungen gemäß MDR, Anhang I (insbesondere Abs. 1 und 8), nachzuweisen.
Wir haben uns die Mühe gemacht dieses Dokument auf Deutsch zu übersetzen. Das ist keine offizielle Übersetzung und kann nur als Hilfe verstanden werden (MEDDEV 2.7 1 Deutsch).
Zusammengefasst kann die klinische Bewertung aus einem Plan zur klinischen Bewertung und einem Bericht zur klinischen Bewertung bestehen, welche u.a. folgende Elemente enthalten:
- Geltungsbereich (eindeutige Identifikation und Beschreibung des Produkts, inkl. Zweckbestimmung, Indikationen, Kontraindikationen, Zielgruppen, Anwender, klinischer Nutzen)
- klinischer Entwicklungsplan (Identifizierung vorhandener und notwendiger Daten)
- Äquivalenzbetrachtung (Bewertung der Gleichartigkeit des Produkts zu äquivalenten Produkten unter Berücksichtigung klinischer, technischer und biologischer Parameter, Bewertung vorhandener Unterschiede)
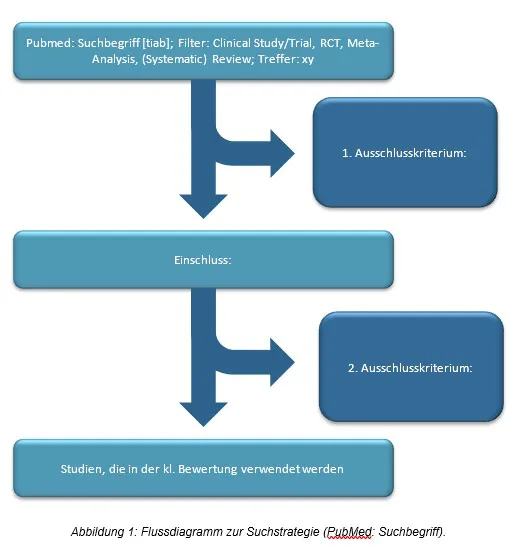
- systematische und transparente Recherche nach aktuell verfügbarer wissenschaftlicher Literatur zur Abbildung des etablierten Stands der Technik und zur Überprüfung der klinischen Wirksamkeit und Sicherheit äquivalenter Produkte
- Beschreibung aller relevanten, positiven und negativen, Ergebnisse sowie deren Analyse in Hinblick auf Relevanz und Signifikanz in Bezug auf das zur Bewertung vorliegende Medizinprodukt
- Schlussfolgerungen bezüglich der Sicherheit und der klinischen Leistung des Produkts einschließlich seines klinischen Nutzens (Performance)
WQS erstellt seit vielen Jahren klinische Bewertungen für Medizinprodukte – wir erstellen ihnen gerne unverbindlich ein Angebot dazu


